Materi
1. Senyawa kimia dalam jasad kehidupan
2. Sel sebagai pusat perhatian dalam biokimia
3. Unsur-unsur penyusun tubuh
4. Biomolekul-biomolekul kompleks utama penyusun tubuh
5. Komponen utama penyusun tubuh
6. Ikatan kimia
7. Ikatan kovalen
8. Ikatan ionic
9. Ikatan hydrogen
10. Ikatan Van Der Waals
11. Air merupakan molekul polar
12. Air bersifat sangat kohesif
13. Sintesis dan degradasi
Senyawa kimia dalam jasad kehidupan
Ilmu Biokimia adalah ilmu yang mempelajari tentang peranan berbagai molekul dalam reaksi kimia dan proses yang berlangsung dalam makhluk hidup. Jangkauan ilmu Biokimia sangat luas sesuai dengan kehidupan itu sendiri. Tidak hanya mempelajari proses yang berlangsung dalam tubuh manusia, ilmu Biokimia juga mempelajari berbagai proses pada organisme mulai dari yang sederhana sampai yang kompleks.
Murray dkk. (2003) mendefinisikan biokimia sebagai “ilmu pengetahuan yang mempelajari dasar kimia kehidupan”. Dalam hal ini, menurut Bahasa Yunani, bios berarti kehidupan.
Sel sebagai pusat perhatian dalam biokimia
Mengingat sel merupakan unit struktural kehidupan, maka biokimia memiliki definisi fungsional yaitu ilmu pengetahuan yang mempelajari unsur-unsur kimia pembentuk sel hidup dan dengan reaksi serta proses yang dijalaninya. Sebagai contoh, dinding sel yang tersusun atas molekul-molekul fosfolipid, protein serta karbohidrat. Contoh lainnya adalah di dalam sitoplasma sel terjadi pemecahan molekul glukosa menjadi piruvat untuk menghasilkan energi. Yang lebih khusus lagi, di dalam mitokondria terjadi reaksi-reaksi metabolik di antaranya siklus Krebs, oksidasi asam lemak, oksidasi piruvat, metabolism asam-asam amino serta masih banyak lagi. Pendeknya, berbagai peristiwa biokimiawi berhubungan dengan sel. Oleh karena itu cakupan biokimia sangat luas meliputi biologi sel, biologi molekuler serta genetika molekuler.
Unsur-unsur penyusun tubuh
Unsur-unsur utama penyusun tubuh adalah karbon (C), hidrogen (H), oksigen (O) dan nitrogen (N). Selain itu masih terdapat beberapa unsur lain yaitu: kalsium (Ca), fosfor (P), kalium (K), sulfur (S), natrium (Na), klor (Cl), magnesium (Mg), besi (Fe), mangan (Mn) dan iodium (I). Rincian dari unsur-unsur tersebut tercantum pada Tabel 1.1.
Tabel 1.1
Perkiraan Komposisi Dasar Tubuh Manusia (Berdasarkan Berat Kering)
| No | Unsur | Persentase | No | Unsur | Persentase |
| 1 2 3 4 5 6 7 | Karbon Oksigen Hidrogen Nitrogen Kalsium Fosfor Kalium | 50 20 10 8,5 4 2,5 1 | 8 9 10 11 12 13 14 | Sulfur Natrium Klor Magnesium Besi Mangan Iodium | 0,8 0,4 0,4 0,1 0,01 0,001 0,00005 |
Biomolekul-biomolekul kompleks utama penyusun tubuh
Unsur-unsur penyusun tubuh sebagaimana disebutkan di atas banyak yang membentuk molekul-molekul besar yang kompleks di dalam tubuh. Di antara biomolekul-biomolekul kompleks tersebut yang merupakan biomolekul kompleks utama adalah DNA, RNA, protein, polisakarida dan lipid. Biomolekul kompleks tersusun atas molekul-molekul sederhana, seperti terinci pada Tabel 1.2.
| No | Biomolekul | Molekul Pembangun | Fungsi Utama |
| 1 2 3 4 5 | DNA RNA Protein Polisakarida berupa glikogen Lipid | Deoksiribonukleotida Ribonukleotida Asam amino Glukosa Asam lemak | Materi genetik Sintesis protein Sangat banyak, umumnya menjadi bagian dari sel yang melangsungkan kerja (enzim, unsur kontraktilitas dll.) Simpanan energi jangka pendek Sangat banyak, misalnya simpanan energi jangka panjang, komponen membran sel dll. |
Komponen utama penyusun tubuh
Anda telah memahami mengenai unsur-unsur serta molekul-molekul kompleks utama penyusun tubuh. Selanjutnya komponen-komponen utama penyusun tubuh terdiri atas air, protein, lemak, mineral serta karbohidrat. Rincian komponen tersebut tertera pada Tabel 1.3.
Tabel 1.3
Komposisi Kimiawi Normal (Pria dengan Berat Badan 65 kg)
| No | Komponen | Berat (kg) | Persentase |
| 1 2 3 4 5 | Air Protein Lemak Mineral Karbohidrat | 40 11 9 4 1 | 61,6 17,0 13,8 6,1 1,5 |
Ikatan kimia
Molekul di dalam tubuh baik yang sederhana sampai dengan yang kompleks dapat terbentuk karena adanya ikatan kimia. Ikatan kimia digolongkan menjadi 2 yaitu ikatan kovalen dan ikatan non kovalen. Selanjutnya ikatan non kovalen terdiri atas ikatan ionik, ikatan hidrogen dan ikatan Van Der Waals.
Ikatan kovalen
Ikatan kovalen adalah ikatan yang terbentuk oleh valensi dari masing-masing atom. Anda dapat mempelajari lagi tentang valensi dengan membaca buku-buku kimia umum, atau pelajaran kimia di SMA. Contoh dari ikatan kovalen adalah CO2. Dalam hal ini valensi C adalah 4 dan valensi O adalah 2.
Gambar 1.1
Ikatan kovalen antara sebuah atom C yang bervalensi 4 dan empat buah atom H yang masing-masing bervalensi 1 membentuk CH4 (metana)
Ikatan ionik
Ikatan ionik adalah ikatan antara dua gugus dengan muatan berlawanan. Contohnya adalah ikatan antara substrat dan enzim. Jarak optimal ikatan ini adalah 28 Angstrom.
Gugus bermuatan negatif pada substrat Gugus bermuatan positif pada enzim
Gambar 1.2
Ikatan ionik antara gugus karboksil bermuatan negatif pada substrat dan gugus amina bermuatan positif pada enzim
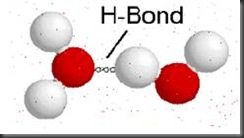
Ikatan hidrogen
Ikatan hidrogen adalah pengikatan satu atom hidrogen oleh dua atom lain yang berbeda. Ikatan ini dapat dibentuk di antara molekul-molekul tidak bermuatan maupun molekul-molekul bermuatan. Atom yang mengikat hidrogen lebih kuat disebut donor hidrogen sedang lainnya dinamakan akseptor hidrogen.
Gambar 1.3
Ikatan hidrogen antar molekul-molekul air (H2O). Perhatikan atom oksigen pada kutub negatif berikatan dengan atom hidrogen pada kutub posif air.
Ikatan Van Der Waals
Iakatan Van Der Waals adalah daya tarik non spesifik, yang berperan pada saat dua atom berjarak 3-4 Angstrom.
Air
Air merupakan produk akhir utama dari metabolisme oksidatif makanan. Dalam reaksi-reaksi metabolik, air berfungsi sebagai reaktan tetapi juga sebagai produk. Air juga menjadi pelarut biologis yang ideal. Air sangat mempengaruhi semua interaksi molekuler dalam sistem biologi. Air mempunyai 2 sifat penting secara biologis yaitu sifat polar dan sifat kohesif.
Air merupakan molekul polar
Secara tiga dimensi, air merupakan molekul tetrahedron tak beraturan dengan oksigen pada bagian pusatnya. Dua buah ikatan dengan hidrogen diarahkan ke dua sudut tetrahedron, sementara elektron-elektron yang tidak dipakai bersama pada kedua orbital terhibridasi sp3 menempati 2 sudut sisanya. Molekul air membentuk molekul bipolar (dua kutub). Sisi oksigen yang berlawanan dengan dua atom hidrogen cenderung bermuatan negatif karena mengandung lebih banyak elektron. Sedangkan disisi hidrogen cenderung bermuatan negatif.
Gambar 1.1
Molekul air. Sisi oksigen adalah kutub negatif dan sisi hidrogen adalah kutub positif.
Air bersifat sangat kohesif
Molekul-molekul air yang berdekatan memiliki afinitas yang tinggi satu sama lainnya. Daerah bermuatan positif dan satu molekul air cenderung akan mengarahkan diri kepada daerah bermuatan negatif pada salah satu molekul didekatnya. Air beku mempunyai struktur kristal yang sangat teratur di mana seluruh ikatan hidrogen potensial memang terbentuk. Air cair mempunyai struktur yang setengah teratur dengan kelompok-kelompok molekul berikatan hidrogen yang secara terus menerus terbentuk dan terpecah.
Gambar 1.2
Afinitas yang tinggi antar molekul air.
Air merupakan pelarut yang sangat baik bagi molekul-molekul polar. Air sangat memperlemah iakatan ionik dan ikatan hidrogen antara molekul-molekul polar dengan cara bersaing daya tarik. Perhatikan contoh pada Gambar 1.3. Atom-atom hidrogen air mengantikan atom hidrogen amida (-NH) sebagai donor ikatan hidrogen, dan atom oksigen air menggantikan atom oksigen karbonil (-CO) sebagai akseptor. Maka ikatan hidrogen yang kuat antara –NH dan –CO terjadi jika tidak ada air.
Gambar 1.3
Air bersaing dalam pembentukan hidrogen, sehingga menjadi pelarut yang baik
Sintesis dan degradasi
Di dalam kehidupan, selalu terjadi peristiwa sintesis dan degradasi komponen-komponen yang menyusunnya.
Sintesis
Sintesis adalah proses pembentukan suatu molekul yang lebih besar, dari molekul-molekul yang lebih kecil. Sebagai contoh, protein adalah molekul yang sangat besar. Protein ini disintesis dari asam-asam amino dengan mekanisme yang sangat rumit.
Gambar 1.4
Sintesis protein di dalam ribosom sel.
Bulatan-bulatan yang berantai merupakan gambaran sederhana dari asam-amino yang bersambungan dengan ikatan peptida membentuk protein.
Contoh lainnya adalah DNA suatu rantai deoksiribonukleotida yang sangat panjang. Setiap mata rantai merupakan satu unit deoksiribonukleotida. Deoksiribonukleotida tersebut terbentuk oleh deoksiribonukleosida dan fosfat, demikian seterusnya sampai dengan komponen yang lebih kecil.
Gambar 1.5
DNA merupakan rantai ganda dari deoksiribonukleotida (rantai biru dan rantai merah). Masing-masing rantai tersusun atas mata rantai berupa deoksiribonukleotida, yaitu unit yang terdiri atas deoksiribosa, basa nitrogen (G, C, A auat T) dan fosfat.
Degradasi
Degradasi adalah pembongkaran molekul-molekul yang lebih besar menjadi molekul-molekul yang lebih kecil. Contohnya adalah degradasi asam amino. Asam-asam amino yang melebihi kebutuhan sintesis protein tidak dapat disimpan dan tidak dapat diekskresikan. Kelebihan asam amino ini cenderung digunakan bahan bakar. Gugus amino dibebaskan selanjutnya sebagian besar menjadi urea, sedangkan rangka karbon diubah menjadi zat antara metabolisme misalnya asetil KoA, asetoasetil KoA, piruvat dll.
Gambar 1.6
Asam amino arginin mengalami degradasi menjadi urea dan ornitin. Selanjutnya urea diekskresikan melalui ginjal.
Referensi:
Murray RK, Granner DK, Mayes PA, Rodwell VW, 2003, Biokimia Harper, Edisi XXV, Penerjemah Hartono Andry, Jakarta: EGC
Stryer L, 1996, Biokimia, Edisi IV, Penerjemah: Sadikin dkk (Tim Penerjemah Bagian Biokimia FKUI), Jakarta: EGC
Harper, Rodwell, Mayes, 1977, Review of Physiological Chemistry
Colby, 1992, Ringkasan Biokimia Harper, Alih Bahasa: Adji Dharma, Jakarta, EGC
Wirahadikusumah, 1985, Metabolisme Energi, Karbohidrat dan Lipid, Bandung, ITB
Harjasasmita, 1996, Ikhtisar Biokimia dasar B, Jakarta, FKUI
Toha, 2001, Biokimia, Metabolisme Biomolekul, Bandung, Alfabeta
Poedjiadi, Supriyanti, 2007, Dasr-dasar Biokimia, Bandung, UI Press
Anonim, 2008. Biology II Notes, http://www.tpsd.org/ths/sciences/b2eukpro.htm,
Anonim, 2003. The Biology Project, http://www.biology.arizona.edu,
Anonim, 2005, WKU Bio 113, http://bioweb.wku.edu/courses/biol115/Wyatt,








Tidak ada komentar:
Posting Komentar